INTRODUCTION TO THE INSTITUTE

可生物降解的級聯納米催化劑用于腫瘤微環境重構,實現可控的CO釋放和腫瘤靶向/協同治療
文章標題:Biodegradable cascade nanocatalysts enable tumor-microenvironment
remodeling for controllable CO release and targeted/synergistic cancer nanotherapy
第一作者:Jianrong Wu
通訊作者:Xiaojun Cai,Yu Chen, and Yuanyi Zheng
通訊單位:上海交通大學附屬第六人民醫院,上海大學
論文導讀:
氣體療法作為一種新興的腫瘤治療方式,由于其低的毒副作用,具有廣闊應用前景的治療策略。然而這種治療模式仍面臨著諸多挑戰,如治療性氣體的精確遞送和可控釋放。針對這一挑戰,上海交通大學附屬第六人民醫院鄭元義教授、蔡曉軍副研究員和上海大學陳雨教授等合作報道了一種級聯生物可降解納米催化劑介導的原位持續釋放CO氣體和磁共振成像監測的靶向/協同腫瘤氣體/饑餓納米治療的“腫瘤微環境重塑”策略。該納米催化劑通過將葡萄糖氧化酶(GOD)和H2O2敏感分子羰基錳(MnCO)包裹在可生物降解的中空介孔有機硅納米粒子中制備而成。GOD首先作為介孔氧化硅的“開關”,隨后修飾靶向多肽(cRGD)用于特異性靶向αvβ3整合素過表達的腫瘤細胞。在腫瘤微酸性的情況下,GOD被解離,釋放負載的MnCO前藥。前藥在H2O2的條件下原位釋放CO氣體。同時,GOD催化腫瘤細胞內葡萄糖分解產生葡萄糖酸和H2O2來重塑腫瘤微環境,進一步促進CO/Mn2+的原位生成。通過細胞實驗和體內異位腫瘤模型驗證表明:納米催化劑通過協同CO氣體和饑餓納米治療,可以獲得了優越的治療性能。本研究為通過重塑腫瘤微環境增強CO介導的抗腫瘤療效提供了一種新的策略。
研究進展:
在這項工作中,研究人員設計了一種智能的靶向/級聯納米催化劑(RGD-GOD-MnCO@HMONs,縮寫為RG-Mn@H) 重構TME,實現CO氣體的原位可控釋放。構建的級聯納米催化劑可在磁共振(MR)引導下用于協同腫瘤饑餓治療與CO氣體治療(圖一)。在TME中,通過GSH誘導的二硫鍵斷裂和pH誘導的亞胺鍵水解打開GOD門衛,繼而使得HMONs的快速生物降解,導致負載MnCO的釋放,MnCO進一步與內源性H2O2和H+反應以實現CO氣體的按需釋放。隨后,釋放的GOD催化葡萄糖生成葡萄糖酸和H2O2。這一過程不僅切斷了細胞的營養來源,而且通過H+和H2O2富集的TME的重構,加速了MnCO的分解,提高了CO的生成。同時,基于釋放出的順磁性Mn2+離子,磁共振T1加權成像也可以監測治療過程。該方法在體外和體內都得到了系統的評價和驗證。
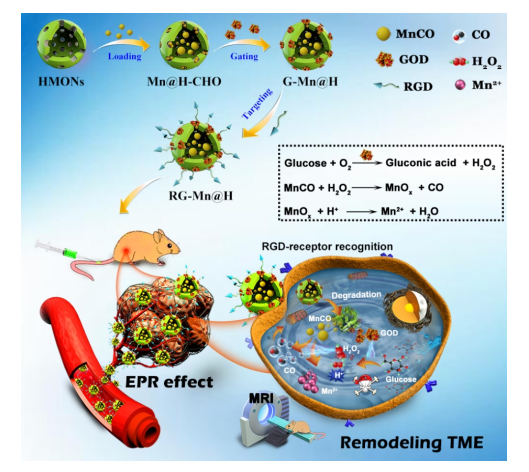
圖一 靶向級聯納米催化劑(RG-Mn@H)的設計及其用于TME的重構,引發連續級聯反應的示意圖
首先,該團隊采用“氨水輔助選擇性蝕刻”方法合成具有二硫鍵摻雜/結合的HMON框架。通常,核/殼SiO2@MONs在三乙醇胺存在下制備。用氨水溶液選擇性地刻蝕SiO2核,形成空心納米結構。透射電子顯微鏡(TEM)圖像顯示,獲得的HMON具有均勻的空心球形拓撲結構,粒徑約為55 nm(圖二a)。相應的能譜分析顯示了C、S、Si和O元素的分布。基于29Si魔角自旋(MAS)和13C交叉極化MAS(CPMAS)固態NMR譜的HMONs組成分析證實HMONs中存在二硫鍵雜化的倍半硅氧烷骨架(圖二b和c),當MnCO封裝后,HMONs-CHO的Zeta電位變為-16.2 mV(圖二d)。從Mn@H-CHO的紫外-可見光譜可以看出(圖二e),在340 nm處發現MnCO的顯著吸收,證實了有效的MnCO封裝,其負載效率為37.5%(w/w%)。GOD作為門控開放,通過形成pH敏感的亞胺共價鍵與HMONs-CHO結合,從而得到一種新的納米催化劑,GOD-MnCO@HMONs (G-Mn@H). 同時,進一步修飾RGD形成最終產物RG-Mn@H 納米催化劑。TEM圖像(圖二f)顯示了RG-Mn@H獨特的球形結構,且平均直徑為66.8 nm,略大于原始的HMONs。元素映射圖像也反映了RG-Mn@H 中Si、C、S、O、N和Mn元素的均勻分布(圖二g)。HMONs-CHO的BET比表面積和孔徑在經過藥物加載、隨后的GOD修飾和RGD連接后表現出明顯的減小。逐步改變的Zeta電位進一步證明了RG-Mn@H的成功合成(圖二d)。
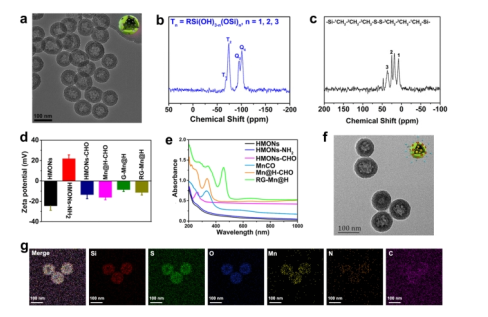
圖二 RG-Mn@H 納米催化劑的表征。(a)HMONs納米粒子的TEM圖像。(b)HMONs的29Si和(c)13C譜。(d)HMONs,HMONs-NH2,HMONs-CHO的zeta電位和(e)紫外-可見吸收光譜。RG-Mn@H的(f)TEM圖像和(g)硅、硫、氧、錳、碳、氮的元素映射mapping圖。
進一步評估RG-Mn@H對TME的重構能力及體外療效。為了深入了解其細胞內吞行為,選擇αvβ3過表達的腫瘤細胞系MDA-MB-231來評估納米催化劑的細胞攝取效率。從激光共聚焦掃描顯微鏡(CLSM)圖像中,RG-Mn@H 與G-Mn@H 組觀察到異硫氰酸熒光素(FITC)熒光信號的增加(圖三a)。另外,當用游離RGD預處理后再與細胞孵育時,熒光強度相應地降低,證明了RG-Mn@H的靶向性主要歸因于表面連接的RGD與αvβ3整合素蛋白的特異性識別。流式細胞術定量進一步證實,通過RGD修飾,這些納米顆粒的細胞內化顯著增加(圖三b)。結果證明:納米催化劑良好的細胞內吞作用有助于腫瘤靶向的MnCO轉運。接著檢測不同處理后MDA-MB-231細胞內H2O2水平(圖三c)。與PBS和G-Mn@H 治療組相比,RG-Mn@H 處理后的細胞內的H2O2隨著時間的延長迅速增加。RG-Mn@H組處理后的細胞內H2O2水平(1.14 mM)比GOD組(0.82 mM)高出約1.5倍。接下來,進一步應用經典的CO熒光探針(COP-1)來評估細胞內H2O2驅動的CO釋放。CLSM圖像顯示,R-Mn@H組未檢測到明顯的綠色熒光,而RG-Mn@H組在pH 5.0下,細胞內的熒光強度隨培養時間的延長而顯著增強,表明細胞內CO的可控釋放(圖三d)。RG-Mn@H在pH 7.4條件下處理的腫瘤細胞只有微弱的熒光信號,這可歸因于穩定的納米催化劑和中性pH條件下GOD出于關狀態。因此,通過重構TME實現H2O2的自供給來控制CO的釋放速率和釋放量是可行的。然后我們進一步檢查RG-Mn@H的體外治療效果(圖三e)。在沒有葡萄糖的環境下,不同納米材料培養的MDA-MB-231癌細胞的存活率與對照組接近。相對而言,通過RG-Mn@H與葡萄糖進行治療,細胞死亡率顯著(86.8%)。這一結果表明,葡萄糖是達到預期治療效果所必需的。同時發現RGD修飾的納米催化劑可以增強對癌細胞的細胞毒性,這是由于主動靶向效應αvβ3-RGD的特定識別。同時,細胞毒性與RG-Mn@H的濃度以及pH值密切相關。此外,鈣黃綠素-AM/PI染色試驗進一步驗證治療效果(圖三f)。
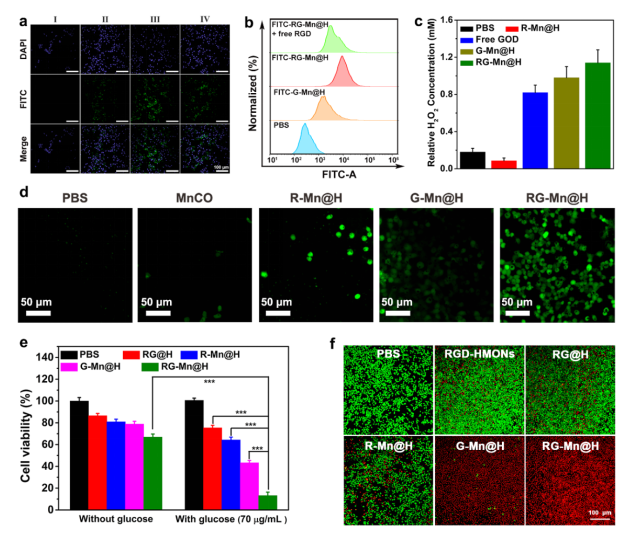
圖 三 (a)不同處理后MDA-MB-231細胞的共焦熒光圖像。所有比例尺都是50 μm。Ⅰ: PBS;Ⅱ: FITC-G-Mn@H (20 μg/mL);Ⅲ: FITC-RG-Mn@H (20 μg/mL);Ⅳ: FITC-RG-Mn@H (20 μg/mL)+ 游離RGD;(b)不同處理后MDA-MB-231細胞的流式細胞術分析;(b, c)不同處理后MDA-MB-231細胞內H2O2含量的變化。(d)用COP-1型CO熒光探針檢測細胞內CO含量([Mn]:10μg/mL)。(e)不同處理后MDA-MB-231細胞相對存活率([Mn]:10 μg/mL)(f)不同處理后鈣黃綠素-AM和PI共染細胞的共聚焦圖像。
最后,研究人員對采用MDA-MB-231乳腺癌模型進行評價RG-Mn@H的腫瘤治療效果。小鼠隨機分為五組:PBS組,RG@H,R-Mn@H,G-Mn@H,和RG-Mn@H。 在整個治療期間監測腫瘤體積和體重。如圖四a所示,采用RG@H治療對腫瘤生長無明顯抑制作用(抑制率為28.6%)。而單獨使用R-Mn@H的小鼠也僅僅得到一定的靜置(抑制率35.5%)。相比之下,G-Mn@H 治療抑制效果更為顯著(抑制率66.7%)。最顯著的應該是協同納米治療組(RG-Mn@H),其在治療期間有顯著的抑瘤作用(抑瘤率94.3%)。通過測定各組代表性小鼠的腫瘤重量和相應的數碼照片進一步證實RG-Mn@H獲得了佳治療效果(圖四b)。與此同時,不同治療組的小鼠體重沒有明顯變化(圖四c),表明所有制劑引起的副作用可以忽略不計。值得注意的是,在注射后30分鐘,小鼠的血糖水平略有下降,然后自發恢復正常,而在后續治療過程中觀察到血糖水平沒有明顯變化(圖四d)。這一結果進一步表明RG-Mn@H不會引發潛在毒性。值得注意的是,RG-Mn@H治療組的小鼠存活率明顯長于其他治療組(圖四e),進一步證明了高協同抗癌作用。為了揭示其抗腫瘤作用的生物學機制,采用蘇木精和伊紅(H&E)、TdT介導的dUTP生物素缺口標記(TUNEL)和Ki-67抗體對各種治療后的腫瘤切片進行染色(圖四f)。可見,RG-Mn@H處理的老鼠組,在H&E染色圖像上顯示最明顯的凋亡/壞死區,而TUNEL染色顯示腫瘤細胞凋亡水平最高。同樣地,Ki-67染色顯示腫瘤細胞的增殖抑制最明顯。
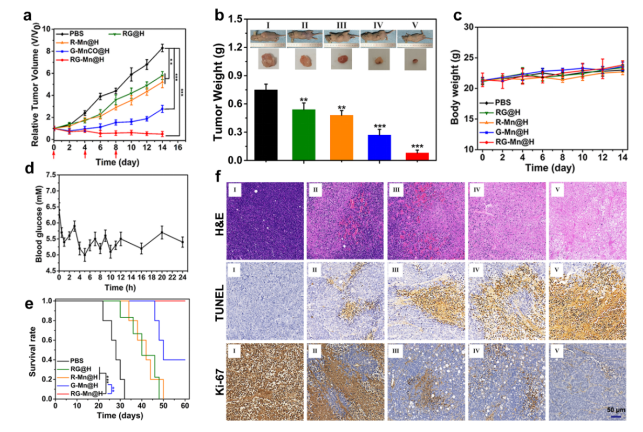
圖四 RG-Mn@H 納米催化劑的體內抗腫瘤效果。(a)不同治療模式在治療期間的腫瘤生長曲線( n= 5)。(b)治療后第14天小鼠腫瘤重量。**P < 0.01,***P < 0.001。插圖:MDA-MB-231荷瘤小鼠的代表性照片和不同治療后小鼠切除腫瘤的相應圖像。Ⅰ:PBS;Ⅱ:RG@H; Ⅲ:R-Mn@H;Ⅳ:G-Mn@H;Ⅴ:RG-Mn@H。(c)治療期間小鼠體重變化(n = 5)。(d) 小鼠靜脈注射RG-Mn@H后的血糖水平(n = 5)。(e)不同治療組后MDA-MB-231荷瘤小鼠2個月生存曲線(n = 5)。(f)MDA-MB-231 荷瘤裸鼠經過不同的治療手段后腫瘤部位的 H&E、TUNEL和Ki67染色圖。比例尺:50 μm。
總結與展望:
上海交通大學附屬第六人民醫院上海超聲醫學研究所(超聲醫學科)聯合上海大學報告了一種靶向/級聯納米催化劑實現原位可控CO釋放和有效氣體治療的“TME重構”。作為一個范例,類似芬頓的前藥MnCO和天然GOD被同時整合到可生物降解的HMONs中來構建RG-Mn@H納米催化劑。RG-Mn@H能夠特異性響應TME并隨后重構TME。當被腫瘤細胞內吞時,RG-Mn@H 發生快速的生物降解同時打開GOD門控開關。隨后,GOD引起的內源性葡萄糖消耗的級聯反應不僅對腫瘤細胞的饑餓治療有顯著的作用,而且還通過提高H2O2水平來重構TME。RGD修飾的納米催化劑具有良好的生物相容性、固有的腫瘤特異性生物降解性和協同抗癌作用,為αvβ3整合素高表達的惡性腫瘤的靶向、高效氣體治療提供了一種新的思路。同時作為智能納米平臺的例子,RG-Mn@H具有重構TME以增強納米治療效果的特定能力。
論文信息:
Biodegradable cascade nanocatalysts enable tumor-microenvironment remodeling for controllable CO release and targeted/synergistic cancer nanotherapy
JianrongWu,ZheyingMeng,AgataA.Exner,XiaojunCai,XueXie,BingHu,YuChen,YuanyiZheng,
Biomaterials
DOI:10.1016/j.biomaterials.2021.121001
原文鏈接:
https://www.sciencedirect.com/science/article/pii/S0142961221003574